Prof. Dr. Walter Hasibeder
DAS RISIKO MALIGNER ERKRANKUNGEN IN PATIENT*INNEN NACH SEPSIS
In dieser schwedischen Studie wurden die Daten von Patient*innen, die eine Sepsis mit Intensivaufenthalt mindestens 1 Jahr lang überlebt haben, mit der schwedischen Datenbank für Tumorerkrankungen gematcht. Jeder Patient bzw. jede Patientin ist in allen schwedischen Gesundheitsdatenbanken durch ihre Patient*innen spezifische Kennnummer eindeutig identifizierbar. Als Vergleichs- oder Kontrollpopulation wurden, gematscht, Schweden ohne Sepsis- Anamnese herangezogen. 18.550 Patient*innen haben zwischen 2005 und 2017 eine schwere, lebensbedrohliche Infektion für mindestens 1 Jahr überlebt. Im Vergleich mit der Kontrollpopulation war die „Site Incident Rate (SIR)“, d.h. die Anzahl der neuen Karzinomerkrankungen in der Sepsis-Kohorte verglichen mit der Anzahl der Karzinomerkrankungen in der Vergleichspopulation der primäre Outcomeparameter.
Die Inzidenz neuer Krebserkrankungen in der Sepsis-Kohorte fast doppelt so hoch, wie in der Kontrollgruppe. Die mediane Beobachtungszeit in der Studie betrug 3,4 Jahre (IQR: 1,72-5,86 Jahre). Die Inzidenz neu auftretender Karzinome betrug 8,8% und war bei Frauen etwas höher (1,7 fach) als bei Männern (1,31-fach). Die SIR war am höchsten bei den jungen Patient*innen < 40 Jahren. Bei Männern und Frauen fand sich ein erhöhtes Krebsrisiko für die Haut, den Gastrointestinaltrakt, Leber, Lunge, Gallenblase sowie das hämatopoetische System. Insgesamt war die SIR am höchsten im 1. Jahr nach Studienbeginn (2. Jahr nach Sepsisdiagnose).
FAZIT: Wir wissen heute, dass schwere Infektionserkrankungen langanhaltende Störungen der Immunhomeostase verursachen können. Dabei spielen neben der Schwere der Infektion und den damit einhergehenden Organfunktionsstörungen auch Patienten-bezogene Faktoren eine wichtige Rolle. Hohes Alter mit Abnahme der normalen immunologischen Funktion, Vorerkrankungen, wie Diabetes mellitus oder Adipositas, die per se häufig mit einer proinflammatorischen Immunsituation einhergehen, prädisponieren zu längerfristig anhaltenden Störungen des Immunsystems. In zahlreichen Untersuchungen wurden vor allem Einschränkungen des spezifische oder adaptiven Immunsystems, aber auch der Funktion natürlicher Killerzellen, die dem unspezifischen Immunsystem zugerechnet werden, gefunden. Gerade natürliche Killerzellen und T-Killerzellen haben eine wichtige Überwachungsfunktion im Körper. Sie erkennen frühzeitig sich entwickelnde Krebszellen und können diese rechtzeitig vernichten.
In Analogie dazu zeigt eine dänische Zwillingsstudie, dass ein schweres Trauma (ISS > 9) ebenfalls zum gehäuften Auftreten von Karzinomerkrankungen aber auch diversen Autoimmunerkrankungen in den darauffolgenden 20 Jahren führt. Das bedeutet, dass auch ein schweres Trauma mit langanhaltenden Störungen der Immunhomeostase einhergehen kann.
Literatur:
- Risk of malignant disease in 1-year sepsis survivors, a registry-based nationwide follow-up study. Hästbacka J et al. Crit Care 2023; doi: 10.1186/s13054-04654-9
- Association of trauma with long-term risk of death and immune-mediated or cancer disease in same-sex twins. Eskesen TO et al. JAMA Surgery 2023; doi: 10.1001/jamasurg.2023.1560
DIE PERIOPERATIVE GABE VON TRANEXAMSÄURE
In dieser Arbeit wurden die Empfehlungen der Arbeitsgemeinschaft Endoprothetik in Zusammenarbeit mit einer Expertengruppe der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin zusammengefasst. Die Basis dieser Empfehlungen sind mehrere Puplikationen der letzten Jahre, die hier kurz aufgeführt werden.
In einer aktuellen Metaanalyse wurden 125.550 Patient*innen aus verschiedenen Fachdisziplinen (Herzchirurgie, Orthopädie und Traumatologie) hinsichtlich dem Auftreten von thrombembolischen Ereignissen mit und ohne perioperative Gabe von Tranexamsäure (TXA) untersucht. Das Auftreten von venösen Thromboembolien, Pulmonalembolien, Apoplex und Herzinfarkt war in beiden Gruppen mit etwa 2% ident. Es bestand kein erhöhtes Thromboembolierisiko nach einer intraoperativen Gabe von TXA. Patient*innen welche TXA erhielten zeigten eine signifikant verminderte Gesamtmortalität und blutungsassoziierte Mortalität.
Eine neue randomisierte-kontrollierte Studie zum perioperativen Einsatz von 1g TXA bei OP-Start und Ende versus Placebo im Rahmen von nicht-kardiochirurgischen Eingriffen zeigt eine signifikante Reduktion lebensbedrohlicher und nicht lebensbedrohlicher Blutungen (-24%). In dieser Untersuchung waren auch Patient*innen mir erhöhtem Thromboembolierisiko (KHK, PAVK, aktive Tumorerkrankungen) eingeschlossen. Auch bei diesen Patient*innen konnte kein erhöhtes Risiko für kardiovaskuläre Komplikationen gefunden werden.
Weiter Studien belegen, dass die Notwendigkeit peri- und postoperativer Transfusionen durch die Gabe von TXA signifikant reduziert werden kann. Bei Patient*innen die einem endoprothetischen Eingriff unterzogen werden, ist die Gabe von TXA mit geringerem Blutverlust verbunden. Kardiovaskuläre Komplikationen scheinen geringfügig, aber nicht signifikant erhöht zu sein! Aus diesem Grund empfehlen die Expert*innen eine individuelle Abwägung des Nutzen/Risiko Verhältnisses, d.h. dass die Entscheidung hinsichtlich der perioperativen Gabe von TXA muss bei Risikopatient*innen immer eine individuelle Entscheidung bleiben.
Zur Dosierung von TXA empfehlen die Expert*innen des Papiers die Anpassung an die Nierenfunktion. Beim Nierengesunden wird in der Regel eine Dosis von 1g, oder eine gewichtsadaptierte Dosis von 10-15mg/kg Körpergewicht TXA, zu OP-Beginn verabreicht. Bei Patient*innen mit schwerer Nierenfunktionsstörung ist TXA kontraindiziert. Bei Patient*innen mit leichter bis mäßiger Nierenfunktionseinschränkung wir wie folgt dosiert:
Serumkreatininspiegel 1,35mg% – 2,82mg% 10mg/Kg TXA alle 12h
Serumkreatininspiegel 2,82mg% – 5,65mg% 10mg/Kg TXA alle 24h
Serumkreatininspiegel > 5,65mg% 5mg/Kg TXA alle 24h
Neben der intravenösen Gabe werden derzeit auch Untersuchungen über andere Applikationswege veröffentlicht. So soll die kombinierte Gabe von TXA iv und intraartikulär hinsichtlich des Blutverlusts einer alleinigen iv Gabe überlegen sein. Darüber hinaus kann TXA auch oral verabreicht werden. Dabei ist die orale Gabe der iv Gabe in ihrer Wirksamkeit gleichzusetzten. Auch hier sind natürlich entsprechende Dosisanpassungen bei renaler Funktionseinschränkung vorzunehmen.
FAZIT: Wichtige Richtlinie für die klinische Praxis! Auch wir wägen das potentielle Nutzen/Risikoprofil bei Hochrisikopatient*innen sorgfältig ab und entscheiden uns für oder gegen die Gabe von TXA individualisiert.
Literatur:
- Association of intravenous Tranexamic acid with thrombembolic events and mortality. Taeber I, et al. JAMA Surgery 2021; 156e210884
- Tranexamic acid in patients undergoing non-cardiac surgery. Deveraux PJ, et al. NEJM 2022; 386: 1986-1997
- Die perioperative Gabe von Tranexamsäure. Von Heymann C, et al. Anästh Intensivmed 2023; 64: V99-V104
INFLUENZA – ÜBER DIE BEDEUTUNG EINER RESPIRATORISCHEN ERKRANKUNG HINAUS
Influenza ist eine saisonal auftretende Viruserkrankung, die über Tröpfchen, Hände und Gegenstände von Mensch zu Mensch übertragen wird. Hohe Übertragungsraten betreffen vor allem Gemeinschaftseinrichtungen wie diverse Heime, Schulen und Fabriken. Die Erkrankung beginnt meist mit hohem Fieber, Muskel und Gelenksschmerzen, häufig extremen Krankheitsgefühl, Halsschmerzen und Husten und dauert meist 2-3 Wochen. Das Problem mit den Influenzaviren ist die dauernde Virusveränderung, die eine bleibende Immunität verunmöglicht. Jährliche Impfungen auf die jeweils aktuellsten Virusstämme verhindern jedoch effektiv schwere Verläufe und damit einhergehende Komplikationen. Leider liegt die Impfrate in den meisten Ländern der Welt, unter der von der WHO empfohlenen 75% Marke und gerade in Österreich erleben wir eine, politisch von rechts geschürte Zunahme der Impfskepsis mit steigenden Infektionszahlen verschiedener Viruserkrankungen.
Die „Global Burden of Disease Study“ schätze 2017, dass weltweit etwa 55 Millionen Infektionen des unteren Respirationstraktes auf Influenza zurückzuführen sind! 8,5 Millionen dieser Infektionen werden als schwer, bzw. sehr schwer eingestuft und resultieren in zirka 145.000 Todesfälle. Andere weniger konservative Studienansätze schätzen die jährliche Anzahl an Influenza Todesfälle auf 290.000-650.000 (4-8.8 Tote pro 1000 Infizierte). In den USA erkranken jährlich 8-20% der Bevölkerung an Influenza. Davon sind 30% der Betroffenen Kinder. In einem systematischen Review der die Jahr 1997-2011 näher beleuchtet zeigt sich, dass eines von fünf nicht geimpften Kindern bzw. einer von zehn nicht-geimpften Erwachsenen pro Jahr an Influenza erkranken.
Schwere Erkrankungen und Todesfälle treten besonders häufig bei älteren, vorerkrankten Personen auf. Bei den 65-74-Jährigen beträgt die Exzess Todesrate pro 100.000 Menschen 2,9-44 und bei > 74-Jährigen 17,9-224 zusätzliche Todesfälle. Bei Erwachsenen unter 65 Jahren liegt die Exzess Todesrate bei 0,1-6,4 Personen und bei Kindern < 5 Jahren bei 2,1-23,8 Personen pro 100.000 Individuen.
Schwangere Frauen stellen ebenfalls eine Risikogruppe dar. Geburtsstillstand, niedriges Geburtsgewicht, vorzeitige Entbindung und Todesfälle treten signifikant häufiger bei ungeimpften Schwangeren mit Influenza auf.
Schon seit längeren ist bekannt, dass kardiovaskuläre Komplikationen in Zeiten der Influenz gehäuft auftreten. In einer Fall-kontrollierten Studie aus Groß Britannien zeigte sich, dass das Risiko einen akuten Myokardinfarkt (AMI) und Schlaganfall zu erleiden im Rahmen von Viruserkrankungen der unteren Atemwege signifikant ansteigt. Bei Influenzaerkrankten steigt das Risiko für einen akuten Herzinfarkt in der ersten Woche nach Influenzadiagnose 6-10-fach gegenüber einer gematschten Vergleichspopulation ohne Infektion an! Das Risiko einen Schlaganfall zu erleiden war 3-8-fach erhöht und dieses erhöhte Risiko persistierte sogar über mehrere Wochen. Patient*innen mit AMI und Influenzainfektion haben ein deutlich erhöhtes Sterberisiko verglichen mit nicht infizierten Patient*innen mit AMI.
Geimpfte Patient*innen mit Herzerkrankungen haben, gegenüber einer nicht geimpften Vergleichspopulation, ein deutlich geringeres Risiko wegen kardialer Komplikationen im Krankenhaus aufgenommen zu werden (zirka – 30%) und ein geringeres Risiko wegen respiratorischer Infektionen im Krankenhaus aufgenommen zu werden (zirka -17%). Die Influenzaimpfung vermindert das Risiko für einen AMI in ihrer Wirksamkeit ähnlich wie eine Statintherapie, eine medikamentöse antihypertensive Therapie oder ein Verzicht auf Rauchen.
Allerdings zeigen jüngere Studien, dass ältere Personen hauptsächlich von einem höher dosierten Influenzaimpfstoff profitieren. Diese Impfstoffe sind immunogener als der Standardimpfstoff und sie werden daher für Personen > 65 Jahre empfohlen. In einer großen Phase III Studie mit > 30.000 Teilnehmer*innen reduzierte der Hochdosis Impfstoff das Risiko schwerer kardiovaskulärer Ereignisse um 17,7%, das Risiko für Pneumonien generell um 40% und das Risiko einer akuten Herzinsuffizienz um 24%.
Das Influenzavirus stellt aber auch ein besonderes Risiko für asthmaerkrankte und Patient*innen mit COPD dar. Sowohl bei Kindern als auch bei erwachsenen ist ein akuter Asthma Anfall ein häufiger Krankenhausaufnahmegrund im Rahmen einer Influenzaerkrankung. Auch Hospitalisierungen im Rahmen einer COPD-Exacerbation sind saisonal auf eine Influenzainfektion zurückzuführen. Influenzaimpfungen reduzieren signifikant das Risiko von Hospitalisation im Rahmen einer Asthmaerkrankung oder COPD.
Patient*innen mit Diabetes mellitus Typ I und II (DM) zeigen ein deutlich erhöhtes Risiko für schwere und tödliche Komplikationen im Rahmen einer Influenzainfektion! DM Patient*innen werden im Rahmen der Influenzaerkrankung häufiger hospitalisiert (zirka 4-fach häufiger), sie sind signifikant häufiger von bakteriellen Superinfektionen, inklusive schwerer bakterieller Pneumonien betroffen und haben ein höheres Risiko einer extremen DM-Entgleisung. Dabei spielen offensichtlich die Effekte des DM auf das Immunsystem eine Rolle.
Influenzaerkrankungen gehen meist mit längerer Bettlägerigkeit einher. Für ältere Mitmenschen bedeutet dies oft einen signifikanten Verlust an Mobilität und damit Eigenständigkeit. In einer kanadischen Studie mit > 5000 Teilnehmer*innen > 65 Jahre zeigten 39% eine über 2 Wochen verlängerte Rekonvaleszenz und 3% gaben an, dass sie sich seit der Influenzaerkrankung nicht mehr erholt haben. Eine Studie aus Pflegeheimen zeigt einen deutlichen Verlust in der Mobilität, häufigen Gewichtsverlust und Neuauftreten oder Verschlechterung von chronischen Weichteilwunden nach einer Influenzaerkrankung. Influenza beim alten Menschen geht auch mit gehäuften Schwindel, Gangunsicherheit und häufigeren Sturzereignissen einher. Virusinfektionen in dieser älteren Patientenpopulation führen zu einer um zirka 15% erhöhten Inzidenz von Hüft-nahen Frakturen.
Die Gesundheitskosten durch Influenzaerkrankungen sind massiv. In den USA werden die Kosten der jährlichen Influenzasaison auf zirka 11,2 Milliarden US$ geschätzt. In Europa wird von 6-14 Milliarden Euro pro Jahr gesprochen. In einer Kanadischen Studie werden die Kosten für einen Influenza bedingten Krankenhausaufenthalt mit $ 14.600.- CAD und die Kosten für Intensivmedizin mit $ 39.470.- angegeben.
FAZIT: Die Influenzaimpfung lohnt sich nicht nur – sie ist eine gesundheits-ökonomisch relevanter Bestandteil der Gesundheitsvorsorge in einer Bevölkerung! Persönlich habe ich wenig Verständnis dafür, dass eine Weigerung von Risikopersonen sich zu Impfen, als Ausdruck persönlicher Freiheit gewertet und so besonders von rechts-populistischen Gruppierungen und Partien propagiert wird, zumal die medizinischen Behandlungskosten durch die Influenzainfektionen ja von der Allgemeinheit bezahlt werden müssen. Ich denke diese „Vollkasko Mentalität“ ist mit einer der Hauptgründe für eine Explosion der Gesundheitskosten und wird, in dieser Form, auf Dauer nicht mehr finanzierbar sein.
Literatur:
The Disease burden of influenza beyond respiratory illness. Macias AE, et al. Vaccine 2020; doi: 10.1016/j.vaccine.2020.09.048
WAS BRINGT DIE ECMO THERAPIE IM KARDIOGENEN SCHOCK?
In dieser randomisierten prospektiven Untersuchung wurden 117 Patient*innen im kardiogenen Schock (SCAI Schock Klassifikation D und E; siehe Abbildung unten) in einen konservativen Therapiearm oder in eine frühe veno-arterielle ECMO-Therapie randomisiert. In der konservativen Gruppe konnte ebenfalls eine ECMO Therapie, bei Versagen aller konservativ-intensivmedizinischen Maßnahmen, begonnen werden. 50% der inkludierten Patient*innen litten an einem ST-Hebungsinfarkt, 23% an dekompensierter Herzinsuffizienz. Das mediane Alter der Patient*innen lag bei 66 Jahren.
Der primäre Outcome Parameter war eine Kombination aus erfolgreicher Schockresuscitation, Tod innerhalb von 30 Tagen oder Implementierung eines alternativen extrakorporalen Kreislaufersatzverfahrens. Bei Letzterem wurde im konservativen Therapiearm auch ein verzögerter ECMO-Einsatz mitgezählt. Zwischen den Gruppen wurde kein Unterschied im kombinierten Outcome Parameter gefunden. Auch die Mortalität war mit zirka 50% in beiden Gruppen nahezu ident. In der konservativen Therapiegruppe benötigten 39% der Patient*innen im Verlauf eine zusätzliche ECMO Therapie. Die Häufigkeit von schweren Ereignissen (Apoplex, Blutungen, Beinischämien) war mit 60% tendenziell in der ECMO-Gruppe höher.
Abbildung: SCAI-Stadien des kardiogenen Schocks
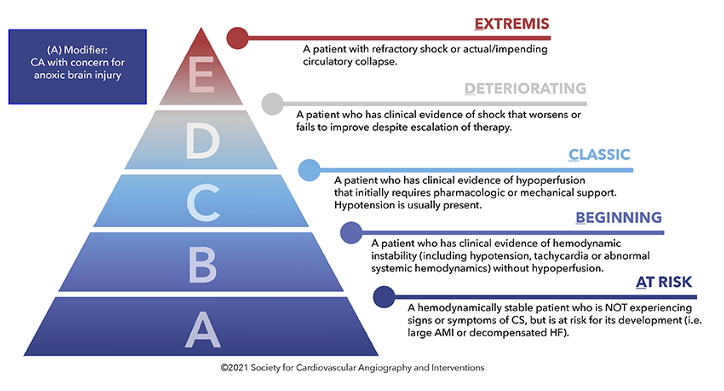
FAZIT: Das ist die bisher größte prospektive Studie zum Einsatz der ECMO im kardiogenen Schock. Die Ergebnisse sind durchaus ernüchternd! Persönlich denke ich, dass die ECMO in ganz spezifischen Einzelfällen positive Ergebnisse erzielen kann, aber die Auswahl dieser Patient*innen müsste nach wesentlich feineren Kriterien als dem SCAI-Stadien erfolgen. Ich denke am ehesten profitieren junge Menschen mit einem gravierenden kardialen Erstereignis, aber sonst normalen Organfunktionen vom sofortigen Einbau einer ECMO, zumal eine Stabilisierung der Herzkreislauffunktion durch sofortige weiterführende interventionelle Diagnostik und Therapie, durchaus möglich ist.
Literatur:
Extracorporal membrane oxygenation in the therapy of cardiogenic shock: Results of the ECMO-CS randomized clinical trial. Ostadal P et al. Circulation 2023; doi: 10.10.1161/CIRCULATIONAHA.122.062949
SOLLTE MAN ANGIOTENSIN CONVERTING ENZYME (ACE) -HEMMER ODER ANGIOTENSIN REZEPTOR BLOCKER (ARB) PERIOPERATIV ABSETZTEN ODER WEITER GEBEN?
Viele Kolleg*innen setzten ACE Hemmer oder ARB einen Tag vor der Operation bis 1-2 Tage nach dem Eingriff ab. Diese Praxis beruht auf mehreren, vor allem Observationsstudien, welche ein gehäuftes Auftreten intraoperativer Hypotension und damit einhergehenden Risiken und Komplikationen aufgezeigt haben.
In der POISE-3 Studie wurden 7500 Patient*innen mit arterieller Hypertension, die meisten unter ACE oder ARB Medikation, in 2 Gruppen randomisiert:
Gruppe no ACE/ARB: Die hypertensive Therapie wurde am Tag vor der OP bereits abgesetzt und erst einige Tage nach dem Eingriff wieder begonnen
Gruppe ACE/ARB: Die antihypertensive Therapie wurde ohne Unterbrechung über die perioperative Phase fortgeführt.
Die Studie zeigte keinerlei Unterschiede in der 30 Tage Inzidenz von akutem Myokardinfarkt, Schlaganfall, Tod oder Herzkreislaufstillstand zwischen den Gruppen (Inzidenz zirka 14% in beiden Gruppen). Allerdings traten intraoperative hypotensive Episoden in der ACE/ARB Gruppe mit 28% häufiger als in der no ACE/ARB Gruppe (24%).
FAZIT: Die Entscheidung hinsichtlich einer Fortführung der Therapie mit ACE oder ARB in der perioperativen Periode muss auch hier individuell erfolgen. Die wichtigen Fragen dazu sind:
Sind große hämodynamische Schwankungen, z.B. durch Blutverluste intraoperativ zu erwarten?
In diesem Fall ist es ratsam am Tag vor der OP bereits ACE und ARB abzusetzen um schwere hypotensive Episoden nach Möglichkeit zu vermeiden
Wie gut ist der arterielle Hypertonus präoperativ eingestellt? Besteht gleichzeitig eine schwere Herzinsuffizienz?
In dieser Situation kann es ratsam sein, eine Therapie mit ACE/ARB perioperativ fortzusetzten. Das vermindert das Risiko hypertensiver Entgleisungen und das Risiko myokardialer Komplikationen
Literatur:
Hypotension-avoidance versus hypertension avoidance strategies in noncardiac surgery: an international randomized controlled trial. Marcucci M, et al. Ann Intern Med 2023; 176: 605-614
BEI WELCHEM HB-WERT SOLLTE MAN PATIENT*INNEN MIT AKUTEM MYOKARDINFARKT UND ANÄMIE TRANSFUNDIEREN?
Im perioperativen Setting wird eine eher restriktive gegenüber einer liberalen Transfusionstherapie als sicher angesehen. Üblicherweise werden Erythrozytenkonzentrate erst bei Hb-Werten < 7g% verabreicht. Inwieweit ein derart restriktives Regimen auch bei Patient:innen mit akutem Myokardinfarkt angewendet werden kann wurde in einer internationalen, randomizierten Studie anhand von 3500 erwachsenen Patient*innen mit akutem Myokardinfarkt und Anämie (Hb < 10g%) näher untersucht.
In einer restriktiven Gruppe wurden Ery-Konzentrate erst bei Hb-Werten unter 8g% verabreicht. In der liberalen Gruppe lag der festgelegte Transfusionstrigger bei 10g%.
30 Tage nach Randomisierung wurden folgende Outcome Parameter evaluiert:
Primäres Outcome: Wiederholter Herzinfarkt oder Tod (16,9% in der restriktiven, 14,5% in der liberalen Gruppe)
Todesfälle: 9,9% in der restriktiven, 8,3% in der liberalen Gruppe
Wiederholter Myokardinfarkt: 8,5% in der restriktiven, 7,2% in der liberalen Gruppe
Akute kardiale Dekompensation: 6,3% in der restriktiven, 5,8% in der liberalen Gruppe
Die liberale Gruppe schnitt in allen gemessenen Ergebnissen etwas besser ab – allerdings waren statistisch gesehen die Resultate nie signifikant. Wie erwartet erhielt die liberale Transfusionsgruppe signifikant mehr Erythrozytenkonzentrate (4300 Einheiten versus 1200 Einheiten in der restriktiven Gruppe).
FAZIT: Das ist die bisher größte Studie zum „richtigen“ Transfusionstrigger bei Patient*innen mit akutem Myokardinfarkt und Anämie. Auch wenn die Ergebnisse in keinem Outcomeparameter signifikant waren, ist ein Trend in Richtung weniger Komplikationen und Todesfälle in der liberalen Gruppe zu erkennen. Ich denke auch hier bleibt es dem Kliniker nicht erspart, am Patient*innenbett die Entscheidung für oder gegen eine Transfusion individuell anhand klinischer Parameter zu treffen. Zum Beispiel wird ein tachykarder Patient mit akutem Myokardinfarkt und Anämie ein deutlich höheres Risiko für kardiovaskuläre Komplikationen inklusive einem Reinfarkt aufweisen – vor allem, wenn die Tachykardie oder Tachyarhythmie trotz antiarhythmischer Therapie bestehen bleibt. In diesem Zusammenhang darf auf eine ältere Publikation von Leung JM et al (Anesthesiology 2000; doi: 10.1097/00000542-200010000-00023) verwiesen werden. 55 gesunde junge Erwachsene wurden isovoläm von einem Ausgangs-HB > 12g% auf Hb-Werte um 5,2mg% diluiert und später wieder mit ihrem Eigenblut auftransfundiert. Die Probanden waren während des gesamten Experiments, in Ruhe, symptomfrei. 3 Proband*innen entwickelten akute ST-Streckenveränderungen im EKG, die durchaus als Ischämie bedingt interpretiert werden konnten. Bei allen dreien trat im Rahmen der isovolämen Hämodilution eine Tachykardie auf. Nachdem die Herzfrequenz, der physiologisch wichtigste Parameter für die linksventrikuläre Durchblutung bei gesunden Herzkrankgefäßen ist, dürften die EKG Veränderungen auf ein Missverhältnis zwischen Sauerstoffangebot und Verbrauch zurückzuführen sein. Man sollte davon ausgehen, dass gerade bei vorgeschädigten Koronargefäßen eine derartige Situation bereits bei milderen Formen der Anämie auftreten kann
Literatur:
Restrictive or liberal transfusion strategy in myocardial infarction and anemia. Carson JL et al. NEJM 2023; doi: 10.1056/NEJMoa2307983
ANTIBIOTIKAVERGLEICHE BEI HOSPITALISIERTEN PATIENT*INNEN MIT COMMUNITY ERWORBENER PNEUMONIE (CAP)
Die amerikanische Infektiologische Gesellschaft und die amerikanische Thorax Gesellschaft empfehlen eine Kombinationstherapie aus ß-Laktam Antibiotika und einem Macrolid oder eine Monotherapie mit einem lungengängigen Fluoroquinolon für die Therapie der CAP. Das Macrolid Antibiotikum kann in Einzelfällen, z.B. bei verlängerten QT-Intervall im EKG, durch Doxycycline ersetzt werden. Eine empirische Abdeckung von Staphylokokkus areus oder Pseudomonas aeroginosa wird nur bei Risikopatient*innen empfohlen.
In einer großen retrospektiven Studie aus Kanada wurde die Mortalität hospitalisierter Patient*innen (n=23.500) mit CAP unter drei unterschiedlichen Antibiotikaregimen untersucht. Intensivmedizinische Patient*innen und Menschen mit Aspirationspneumonien wurden nicht in die Studie inkludiert. 40% der CAP-Patient*innen erhielten eine Kombinationstherapie aus einem ß-Laktam und einem Macrolid; 39% erhielten nur ein ß-Laktam; 19% nur ein Fluoroquinolon und 2% eine ß-Laktam Antibiotikum in Kombination mit Doxycyclin.
In den Auswertungen waren die Kombinationstherapien mit der Monotherapie mit Fluoroquinolonen gleichwertig. Eine alleinige Therapie mit ß-Laktam Antibiotikum war mit verlängertem Krankenhausaufenthalt und einer leicht erhöhten Mortalität (+1,5%) assoziiert.
FAZIT: ß-Laktam Antibiotika sollten bei CAP nie alleine eingesetzt werden! Auch wenn in der Gruppe der Patient*innen die eine Kombinationstherapie aus ß-Laktam Antibiotika mit Doxycyclinen nur wenig Personen inkludiert waren, kann diese Kombination durchaus sinnvoll sein, wenn gegen eine Kombination mit Macroliden klinisch Faktoren entgegenstehen
